Влияние гормонов гипофиза на развитие ребенка

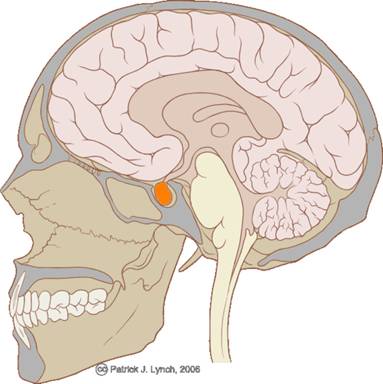 Гипо́физ — мозговой придаток в форме округлого образования, расположенного на нижней поверхности головного мозга в костном кармане, называемом турецким седлом, вырабатывает гормоны, влияющие на рост, обмен веществ и репродуктивную функцию. Является центральным органом эндокринной системы.
Гипо́физ — мозговой придаток в форме округлого образования, расположенного на нижней поверхности головного мозга в костном кармане, называемом турецким седлом, вырабатывает гормоны, влияющие на рост, обмен веществ и репродуктивную функцию. Является центральным органом эндокринной системы.
Вес гипофиза составляет около 0,5—0,6 г., он состоит из двух крупных различных по происхождению и структуре долей: передней — аденогипофиза (составляет 70—80 % массы органа) и задней — нейрогипофиза. Вместе с нейросекреторными ядрами гипоталамуса гипофиз образует гипоталамо-гипофизарную систему, контролирующую деятельность периферических эндокринных желёз.
Закладка гипофиза происходит на 4—5 неделе эмбриогенеза. Передняя доля гипофиза развивается из эпителиального выпячивания дорсальной стенки ротовой бухты в виде пальцевидного выроста (кармана Ратке), направляющегося к основанию головного мозга, в области III желудочка, где встречается с будущей задней долей гипофиза, которая развивается позднее передней из отростка воронки промежуточного мозга.
Гипофиз тесным образом соединен с гипоталамусом — отделом мозга, играющим важнейшую роль в регуляции многих процессов в организме, в том числе в поддержании постоянства внутренней среды, терморегуляции, деятельности внутренних органов. Гипоталамус содержит как нервные клетки, участвующие в деятельности вегетативной нервной системы (регулирующей многие функции внутренних органов), так и секреторные клетки, которые вырабатывают так называемые рилизинг-гормоны. Эти гормоны призваны оказывать строго специфическое воздействие на гипофиз, побуждая его повышать или снижать выработку тех или иных гормонов в зависимости от потребностей организма.
Гипофиз ребенка при рождении имеет массу около 0,12 г. Его рост и функциональное развитие продолжается до 20-летнего возраста. А поскольку гипофиз является регулятором деятельности всех остальных желез внутренней секреции, то его функциональная незрелость обусловливает некоторую нестабильность всей эндокринной системы ребенка. Одним из гормонов выделяемых гипофизом является соматотропин, который называют гормоном роста за то, что у детей и подростков, а также молодых людей с ещё не закрывшимися зонами роста в костях он вызывает выраженное ускорение линейного (в длину) роста, в основном за счет роста длинных трубчатых костей конечностей. Соматотропин оказывает мощное анаболическое и анти-катаболическое действие, усиливает синтез белка и тормозит его распад, а также способствует снижению отложения подкожного жира, усилению сгорания жира и увеличению соотношения мышечной массы к жировой. Кроме того, соматотропин принимает участие в регуляции углеводного обмена — он вызывает выраженное повышение уровня глюкозы в крови и является одним из антагонистов инсулина по действию на углеводный обмен. Описано также его действие на островковые клетки поджелудочной железы, иммуностимулирующий эффект, усиление поглощения кальция костной тканью и др. Многие эффекты гормон роста вызывает непосредственно, но значительная часть его эффектов опосредуется инсулиноподобными факторами роста, который вырабатывается под действием гормона роста в печени и стимулирует рост большинства внутренних органов.
Источник
Рост – это один из наиболее важных показателей здоровья ребенка.
Эта статья посвящена гипопитуитаризму – заболеванию эндокринной системы с изолированным дефицитом гормона роста (соматотропный гормон) или множественным дефицитом гормонов, которые вырабатывает гипофиз.
Важно знать причины, особенно, генетические механизмы развития заболевания, а также классификацию этой патологии, клиническая картина и ее варианты, диагностика и критерии направления к детскому эндокринологу, и необходимые обследования в рамках наблюдения ребенка с гипопитуитаризмом.
Что такое гипофиз и почему возникает гипопитуитаризм
Гипопитуитаризм – эндокринная патология, которая характеризуется снижением или полным отсутствием секреции одного (соматотропный или гормон роста) или более гормонов гипофиза.
Гипофиз — это основная железа эндокринной системы, что входит в гипоталамо-гипофизарную систему, контролирующую функционирование периферийных эндокринных желез.
Этот термин от латинского слова hypophysis, что означает «отросток» и имеет следующие синонимические названия как «нижний придаток мозга» или «питуитарная железа».
Эта эндокринная железа расположена в центральной части головного мозга на турецком седле, хорошо защищена подкоркой правого и левого полушарий.
Какие гормоны продуцирует гипофиз
Гормоны выделяет передняя доля – аденогипофиз, задняя доля гипофиза выполняет нейроэндокринную функцию и участвует в стабилизации артериального давления и водно-солевого баланса. Промежуточная доля соединяет эти доли и является проводником сигналов от гипоталамуса.
Нарушения в строении или функционировании гипофиза вызывают патологические изменения в организме, связанные с недостатком продукции гормонов:
- соматотропный гормон (СТГ) – влияет на роста всех клеток организма, интеллектуальное и физиологическое развитие, обмен веществ;
- тиреотропный гормон (ТТГ) – активирует работу щитовидной железы и продукции ее гормонов, а также фосфолипидов и нуклеиновой кислоты;
- адренокортикотропный гормон (АКТГ) – активирует работу гормонов коры надпочечников (кортизола, кортизона и кортикостерона);
- гонадотропные гормоны (лютеинизирующий и фолликулостимулирующий гормон ЛГ и ФСГ) – стимуляторы секреции гормонов половыми железами;
- пролактин – гормон стимулирующий рост молочных желез, лактацию, регулирующий функцию половых желез (яичников или яичек) и иммунные процессы.
Гипопитуитаризм связан с недостатком продукции соматотропного гормона (изолированная соматотропная недостаточность) и других гормонов гипофиза (пангипопитуитаризм).
Возможно более позднее развитие дефицита других гормонов гипофиза через несколько лет после манифестации изолированной соматотропной недостаточности.
В связи с этим развиваются симптомы, которые характеризуют недостаток действия этих гормонов в организме – гипотиреоз, гипокортицизм, гипогонадизм (задержка или отсутствие полового созревания), несахарный диабет.
Причины
Выделяют врожденный гипопитуитаризм и приобретенный гипопитуитаризм.
Врожденный гипопитуитаризм может развиваться в результате:
- пренатальной и родовой травмы;
- внутриутробного поражения структур гипофиза – дефекты развития (гипоплазии или аплазии);
- мутациями в генах, контролирующих продукцию СТГ.
Помимо этого, врожденный гипопитуитаризм может являться составной частью врожденных «синдромов дефекта среднего мозга». Наиболее частой патологией в этой группе является септооптическая дисплазия, характеризующаяся агенезией/гипоплазией зрительных нервов, прозрачной перегородки и мозолистого тела, и разной степенью нарушения зрения.
Приобретенный гипопитуитаризм возникает:
- после травм головы;
- после хирургических вмешательств в связи с повреждением гипофизарной ножки;
- появления опухолей гипофизарно-гипоталамической области;
- при облучении головы и шеи (при лейкозе, лимфогранулематозе, ретинобластоме);
- после проведения химиотерапии;
- воспаления (энцефалит и менингит, аутоиммунный гипофизит);
- сосудистых патологий — аневризмы сосудов гипофиза, инфаркт гипофиза.
Наследственные формы гипопитуитаризма
Генетическая основа дефицита гормона роста при наличии родственников первой степени родства с той же патологией (с ростом ≤3 стандартных отклонений (SDS)).Они встречаются в 5—30% случаев.
Выделяют наследственный изолированный дефицит гормона роста (ИДГР) или множественный дефект гормонов аденогипофиза (МДГА)
Наследственный изолированный дефицит СТГ ассоциирован с 5 типами различных заболеваний:
- Тип 1А и 1В, которые наследуются по аутосомно-рецессивному типу – у каждого из родителей должен присутствовать соответствующий дефектный ген GH — I (грубые мутации или делеции).
- Тип II наследуется по аутосомно-доминантному типу – один из родителей болен ИДГР.
- Тип III – наследуется как сцепленный с Х – хромосомой и сочетается с гипоглобулинемиями.
Тип 1А протекает значительно тяжелее – отмечается выраженная задержка роста и тяжелый дефицит соматотропного гормона, у детей всегда возникают гипогликемические состояния.
При всех этих формах отмечаются низкие уровни продукции СТГ после проведения проб, для уточнения диагноза проводится молекулярно-генетическое обследование.
Заболевания, с множественным дефицитом гормонов аденогипофиза связаны с мутациями в генах, кодирующих гипофизарные транскрипционные факторы, участвующие в эмбриогенезе аденогипофиза. К данным генам относятся гены: POU1F1 (PIT-1), PROP-1, LHX-3, LHX-4, HESX-1, Pitx2
Большинство мутаций гена PIT-1, который регулирует развитие гипофиза в периоде эмбрионального развития, обнаруженных на сегодняшний день, имеют рецессивный характер наследования (т.е должны присутствовать у обеих родителей важный фактор – близкородственные браки. При этой генной мутации отмечается дефицит гормона роста и пролактина, с возможным снижением секреции гормонов щитовидной железы.
Ген PROP1 (prophet of Pit1) кодирует одноименный белок, который так же, как и PIT-1, является фактором транскрипции. Дефект данного гена является наиболее часто встречающейся генетической причиной при гипопитуитаризме (соматотропной недостаточности), к которой часто в течение жизни присоединяются гипогонадизм (нарушения полового созревания, чаще в подростковом возрасте) и гипокортицизм у подростков или даже после 20-30 лет жизни. Поэтому детей необходимо наблюдать длительно. Важно помнить, что в 20 % случаев при данной генетической патологии отмечается гиперплазия (увеличение) гипофиза при обследовании МРТ, которая проходит самостоятельно и не требует оперативного вмешательства. В настоящее время подобная МРТ-картина у ребенка любого возраста с дефицитом СТГ/Пролактина/ТТГ является показанием для молекулярной диагностики, в первую очередь, для анализа гена PROP-1.
Особенности приобретенных форм болезни
Особенностью приобретенной соматотропной недостаточности, вне зависимости от причин ее возникновения, является тот факт, что она в большинстве случаев сочетается с дефицитом других тропных гормонов (ТТГ, АКТГ, ЛГ и ФСГ), однако «выпадение» гипофизарных гормонов происходит не одновременно, а имеет определенную стадийность.
Вместе с тем секреция соматотропного гормона, являясь, по-видимому, наиболее чувствительной к действию повреждающего фактора, страдает в первую очередь. Гораздо реже развивается несахарный диабет (при поражении гипоталамических ядер или повреждении воронки гипофиза).
Главные причины:
- Опухоли гипоталамуса и гипофиза
(краниофарингиома, аденома гипофиза). - Опухоли других отделов мозга
(глиома зрительного нерва). - Травмы (черепно-мозговая травма, хирургическое повреждение ножки гипофиза).
- Инфекции (вирусный или бактериальный энцефалит и менингит, неспецифический гипофизит).
- Супраселлярные арахноидальные кисты, гидроцефалия, синдром «пустого турецкого седла»
- Сосудистая патология (аневризмы сосудов гипофиза, инфаркт гипофиза).
- Облучение головы и области шеи (лейкемия, ретинобластома, другие опухоли головы и шеи, общее облучение всего тела (например, пересадка костного мозга).
- Токсическое воздействие химиотерапии.
- Инфильтративные болезни (гистиоцитоз, саркоидоз).
врач-педиатр, детский эндокринолог Сазонова Ольга Ивановна
Источник
 Эндокринная система человекарегулирует функции клеток, тканей и органов в процессе всей его жизнедеятельности. При этом каждому возрасту соответствует определённый уровень эндокринной регуляции. При нормальных условиях развития ребенка происходит особая в каждом периоде гормональная активация трофической функции, интенсивный рост и тканевая дифференцировка. Если ребёнок живёт в неблагоприятных условиях, у него выключаются механизмы эндокринной компенсации, которые помогают его организму преодолеть влияние среды. Недостаточная функция эндокринных желез приводит к нарушению реакций приспособления.
Эндокринная система человекарегулирует функции клеток, тканей и органов в процессе всей его жизнедеятельности. При этом каждому возрасту соответствует определённый уровень эндокринной регуляции. При нормальных условиях развития ребенка происходит особая в каждом периоде гормональная активация трофической функции, интенсивный рост и тканевая дифференцировка. Если ребёнок живёт в неблагоприятных условиях, у него выключаются механизмы эндокринной компенсации, которые помогают его организму преодолеть влияние среды. Недостаточная функция эндокринных желез приводит к нарушению реакций приспособления.
Центральным звеном гормональной системы у детей (как и у взрослых) является гипоталамус. Гормоны гипоталамуса называют термином «рилизинг-гормон» (RH) или «рилизинг- фактор» (RF). Рилизинг-гормоны регулируют деятельность гипофиза. Гипофиз состоит из трех долей — передней, средней и задней. В передней части образуются 6 гормонов: АКТГ (аденокортикотропный), СТГ (соматотропный), ТТГ (тиреотропный), ФСГ (фолликулостимулирующий), ЛГ (лютеинизирующий), ЛТГ (лактогенный гормон или пролактин). В средней или промежуточной доле образуется меланотропный гормон (мелатропин). Гормоны задней доли (нейрогипофиза) — окситоцин и вазопрессин (антидиуретический гормон).
Гормоны гипофиза регулируют деятельность желез внутренней секреции: щитовидной, паращитовидных, половых, надпочечников, поджелудочной железы.
Щитовидная железа у новорожденных имеет массу 1-5 г, она немного уменьшается в размерах до 6 месяцев и затем наступает период её роста. К 5-6 годам масса железы увеличивается до 5,3 г, а к 14 годам — до 14,2 г. С возрастом в железе увеличиваются размеры узелков, содержание коллоида, увеличивается число фолликулов . Окончательное гистологическое созревание щитовидной железы происходит к 15 годам.
Основные гормоны щитовидной железы — это тироксин и трийодтиронин (Т4 и Т3). Она производит также тиреокальцитонин (кальцитонин). Эти гормоны влияют на рост, созревание скелета, дифференцировку мозга и интеллектуальное развитие, развитие структур кожи. Гормоны щитовидной железы регулируют потребление кислорода, углеводов и аминокислот тканями, они являются стимуляторами метаболизма, роста и развития ребенка.
Поджелудочная железа осуществляет экзокринную и эндокринную функции. Эндокринная функция поджелудочной железы связана с деятельностью островковых клеток. Глюкагон производят альфа-клетки, инсулин — бета-клетки. После дифференцирования островков уже после рождения в поджелудочной железе обнаруживаются дельта-клетки, вырабатывающие соматостатин.
Инсулин влияет на обмен глюкозы, снижая её уровень в крови. Глюкагон, наоборот, повышает уровень глюкозы в крови. Соматостатин участвует в регуляции роста и развития ребенка.
Паращитовидные железы у новорожденного имеют массу 5 мг, до 10 лет достигают 40 мг, у взрослого — 75-85 мг. В целом после рождения функция паращитовидных желез постепенно уменьшается. Максимальная их активность наблюдается в перинатальный период и на 1-2 году жизни. Они влияют на остеогенез и напряженность фосфорно-кальциевого обмена. Гормон паращитовидных желез – паратгормон(паратиреоидный гормон) — регулирует всасывание кальция и фосфора из кишечника и дальнейшее их усвоение, а так же реабсорбцию кальция в канальцах почек
При гипопаратиреозе уровень кальция в крови у детей снижен до 0,9-1,2 ммоль/л, а уровень фосфора повышен до 3,0-3,2 ммоль/л. При гиперпаратиреозе, напротив, в крови повышен уровень кальция до 3-4 ммоль/л, а содержание фосфора снижено до 0,8 ммоль/л. Клинически при гипопаратиреозе отмечаются судороги (спастические приступы), склонность к неустойчивому или жидкому стулу, позднее прорезывание и раннее разрушение зубов, повышенная нервно-мышечная возбудимость.
При гиперпаратиреозе определяют мышечную слабость, запоры, боли в костях, переломы костей, образование кальцификатов в почках.
Надпочечники — парный орган. Ткань надпочечника состоит из двух слоев: коркового и мозгового. Масса и размеры надпочечников зависят от возраста ребенка. У новорожденного размер надпочечника составляет примерно 1/3 размера почки, масса одного надпочечника до 7 г. Надпочечники детей по строению отличаются от подобного органа у взрослых. У новорожденных корковая зона относительно шире и массивнее и состоит из множества клеток с большим числом митозов. Окончательное формирование коркового слоя заканчивается к 10-12 годам.
В процессе родов ребенок от матери получает большое количество гормонов надпочечников — кортикостероидов. Поэтому у него подавлена адренокортикотропная функция гипофиза. В первые дни после рождения с мочой активно выводятся метаболиты материнских гормонов. Поэтому у ребенка до 10-го дня могут развиваться признаки надпочечниковой недостаточности. С возрастом происходит активизация функции выделения гормонов надпочечников.
При острой надпочечниковой недостаточности у детей падает АД, развивается одышка, пульс становится нитевидным, бывает рвота (иногда многократная), жидкий стул, резкое снижение сухожильных рефлексов. В крови у таких детей растет уровень калия (до 24-45 ммоль/л), снижается уровень натрия и хлора. Ведущая роль при этом синдроме принадлежит минералокортикоидам, хотя наблюдается и общее снижение всех гормонов надпочечников.
При хронической надпочечниковой недостаточности может быть недостаток выработки гормонов кортизола или альдостерона. При недостатке кортизола постепенно развивается неспособность противостоять стрессовым ситуациям, склонность к вазомоторным коллапсам; возникают приступы гипогликемии, вплоть до судорог; мышечная слабость, ощущение усталости, отказ от игры, склонность к дыхательным расстройствам, поворотное появление кожных (сыпи) или дыхательных (бронхоспазма) аллергических реакций; наблюдается волна острых или обострения хронических очагов инфекции; отмечается ускоренный рост миндалин или аденоидов; субфебрилитет; в крови лимфоцитоз и эозинофилия.
При недостатке выработки альдостерона отмечаются артериальная гипотензия, рвота, диарея, снижение прибавки массы тела, дегидратация, мышечная слабость. В крови определяются гипонатриемия, гиперкалиемия, ацидоз, увеличение гематокрита.
При хронической недостаточности коры надпочечников (гипокортицизм) появляется изменение кожи в виде пигментации серовато-дымчатого, коричневого, бронзового или черного цвета, которая захватывает складки кожи и ее открытые участки (на лице и шее).
При гиперпродукции гормонов надпочечников развивается синдром Кушинга. При нем наблюдается ожирение преимущественно на лице и туловище, при этом руки и ноги тонкие.
Адреногенитальный синдром характеризуется нарушением водно-электролитного баланса (за счет рвоты и поноса), изменением вторичных половых признаков. У девочек это явления маскулинизации (развитие половых органов, напоминающие мужской тип), у мальчиков — признаки преждевременного полового созревания. В конечном счете, у этих детей отмечается преждевременное прекращение роста.
Половые железы (яички, яичники) осуществляют длительный процесс формирования пола у детей до возраста полового созревания. Во внутриутробном периоде происходит закладка мужского или женского генотипа, который формируется к периоду новорожденности. В дальнейшем происходят рост и развитие половых органов в соответствии с их дифференцировкой. В целом эндокринная система у детей (до начала полового созревания) характеризуется высокой чувствительностью гипоталамуса к минимальным изменениям концентрации андрогенов в крови. Осуществляется сдерживающее влияния гипоталамуса на выработку гонадотропных гормонов гипофиза.
У детей в разные возрастные периоды совпадают показатели по костному возрасту по массе тела, отдельно для мальчиков и девочек. Признаки полового развития и их последовательность зависят от возраста детей.
У девочек:
- в 9-10 лет — растут кости таза, округляются ягодицы, незначительно приподнимаются сосков молочных желез;
- в 10-11 лет — куполообразно приподнимаются молочные железы (стадия «бутона»), появляются волосы на лобке;
- в 11-12 лет — увеличиваются наружные половые органы, изменяется эпителий влагалища;
- в 12-13 лет — развивается железистая ткань молочных желез и прилегающих к околососковому кружку участков, происходит пигментация сосков, появляются первые менструации,
- в 14-15 лет — изменяется форма ягодиц и таза
- в 15-16 лет — налаживаются регулярные менструации,
- в 16-17 лет – практически останавливается рост скелета.
Перестройка наружных половых органов сопровождается изменениями внутренних половых органов — влагалища, матки, яичников.
У мальчиков:
- в 10-11 лет — начинается рост яичек и полового члена;
- в 11-12 лет — увеличивается предстательная железа, начинает расти гортань;
- в 12-13 лет – происходит значительный рост яичек и полового члена, появляются уплотнения околососковой области, начинается изменение голоса;
- в 14-15 лет – начинается рост волос в подмышечных впадинах, происходит дальнейшее изменение голоса, появляются волосы на лице, пигментируется мошонка, начинаются первые эякуляции;
- в 15-16 лет — созревают сперматозоиды;
- в 16-17 лет – происходит оволосение лобка по мужскому типу, растут волосы по всему телу, появляются зрелые сперматозоиды;
- в 17-21 год – практически останавливается рост скелета.
Наиболее контролируемыми признаками у мальчиков могут быть размеры яичек и полового члена. Яички измеряют с помощью орхидометра, половой член — сантиметровой лентой.
Исследование пола и полового созревания является врачебной процедурой. Вторичные половые признаки учитывают в баллах с учетом стадий развития. При этом у девочек аббревиатурой МА 0,1, 2,3 определяют стадию развития молочных желез; развитие волос в подмышечных впадинах обозначают как Ах 0,1,2,3,4; становление менструальной функции обозначают как Ме 0,1,2,3. У мальчиков оволосение подмышечных впадин обозначают как АХ 0,1,2,3,4, оволосение лобка — как Р 0,1,2,3,4,5; рост щитовидных хрящей – L 0,1,2; оволосение лица – F 0,1,2,3,4,5.
Осмотр половых органов ребенка обязательно проводят в присутствии родителей.
Источник

